不对称有机催化剂

不对称有机催化是一种强大的合成工具,它的出现弥补了金属催化反应的不足。1970年代,Eder等以及Hajos等分别报道了L-脯氨酸[L476193]催化的分子内不对称Aldol反应[1-2],从而开创了这个领域的先河。不过该反应在当时被认为是个特例。之后在2000年,List等也报道了L-脯氨酸催化的分子内不对称Aldol反应[3]。同一年,MacMillan等记录了首个高对映选择性胺催化Diels-Alder反应[4]。这些报道引起了广泛的关注,对不对称催化剂领域的研究自此大量展开[5]。
![]()

随后,MacMillan将L-脯氨酸催化反应用于糖类的合成,从而证明了这类反应的重要性[6]。Córdova等则报道了在脯氨酸的催化作用下,受保护的羟基乙醛一步转化为己糖的不对称反应[7]。
![]()
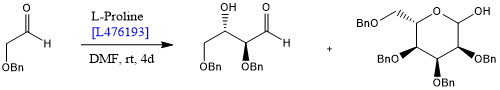
与传统的过渡金属络合物催化剂相比,不对称有机催化剂的优点包括操作简便,易得并且低毒,这对药物生产有直接的好处,对绿色化学也有贡献。
在不对称有机催化最初的巨大进展中,脯氨酸及其类似物发挥了主要的作用。通常,酮类作为受体的有机催化Aldol反应中,催化剂用量高,而该领域近期的发展则降低了催化剂的用量。 Nakamura等报道了(R)-Convolutamydine的对映选择性合成,使用了5mol%的新型N-杂环芳基-磺酰基脯氨酰胺[T121188][8]。该反应中,催化剂的用量可以降低到0.5mol%,即可保留对映选择性,尽管反应需要更长时间才能完成。
![]()

Singh等基于脯氨酸开发出一类新的有机催化剂,并将其用于不对称直接Aldol反应,得到了优异的对映选择性(>99%ee)。该反应对于多种酮和醛都适用,且催化剂[S161308]用量仅为0.5 mol%[9]。
![]()

由于这类有机催化剂的简单易得性和多样性等诸多优点,利用其它氨基酸作为有机催化剂的不对称反应也得到了广泛的研究。近来,Lu的团队尝试基于氨基酸结构获取大量的新型多功能有机催化剂[10]。二肽衍生的膦化合物[O356869]作为一种新的催化剂,已被证明可以促进丙二烯与丙烯酸酯或丙烯酰胺之间的对映选择性[3+2]环加成反应。
![]()

金鸡纳碱及其衍生物广泛用于金属催化的手性配体或作为有机催化剂,其与OsO4形成金鸡纳碱复合物可用于Sharpless不对称双羟基化反应[11]。其奎宁环上的叔胺可以成为Brønsted碱催化,Lewis碱催化,以及亲核催化的活性中心。奎宁环上的氮经烷基化后,得到的铵盐则可以用作相转移催化剂,即另一类有机催化。Hatakeyama,Ishihara等开发出了α-异铜色树碱(a-ICPN)[R404395],β-6'-羟基异辛可宁[B152673]的一种伪对映体,并将其应用于MoritaBaylis-Hillman (MBH)反应[12]。
![]()

20世纪80年代,N-苄基辛可宁卤化物作为手性相转移催化剂被用于氨基酸的不对称合成以来[13],大量由金鸡纳碱衍生的手性相转移催化剂被开发了出来[14]。 90年代末期,出现了一种设计手性相转移催化剂的全新角度即基于C2-对称手性联萘骨架[15]。对于简化催化剂持续不断的努力,可以在更加温和条件下获得优秀对映选择性的新型催化剂也被开发出来。Maruoka等报道了一种3-氧化羟吲哚对Michael受体的对映选择性共轭加成,该反应使用了一种新开发出的吗啉衍生物手性相转移催化剂[B405698],不需要加碱,在中性条件下、富含水的溶剂中即可进行[16]。
![]()

亲核卡宾是一类新兴的不对称有机催化剂。自从首个不对称分子内Stetter反应被Enders等报道后,出现了很多通过N-杂环卡宾(NHC)催化剂介导醛的极性转换实现不对称C-C键形成的报道[17]。Bode等利用一种原位生成的NHC催化剂[A466993],高度对映选择性催化Diels-Alder反应制备出二氢吡啶酮[18]。
![]()

咪唑烷酮衍生物[R405171][S161185]是由MacMillan等开发的不对称有机催化剂,使用R405171和S161185的多种类型的不对称反应已有报道,例如Mukaiyama Michael加成[19],α,β-不饱和醛的环氧化[20],醛的1,3-加成[21]和Diels-Alder反应[22]。在所有情况下均能以高收率和高选择性得到目标产物。该反应常用于天然产物的全合成,也可用于构建复杂的稠环结构(如在多杀菌素中发现的)[23]。因此,R405171和S161185是不对称反应的有力工具,其在新型不对称反应中的应用值得期待。
![]()
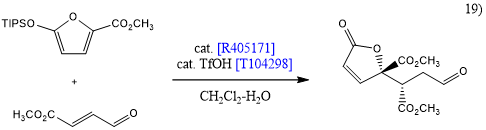
![]()

![]()

R468479和I135692这两种脯氨醇衍生物被称为Hayashi-Jørgensen催化剂,可用于多种类型的不对称反应。例如,Hayashi等报道了硝基烯烃和醛的不对称Michael加成,得到了具有高对映选择性和非对映选择性的syn加成物[24]。此外,以该反应作为关键前期步骤,缩短了抗流感药磷酸奥司他韦的合成流程[25]。 此外,Jørgensen的团队还报道了串联型Michael/分子内Morita-Baylis-Hillman反应,得到了环己酮衍生物[26]。
![]()

![]()
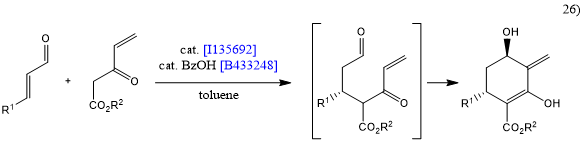
Ishihara的团队开发了一种用于对映选择性螺内酯化的新型碘代芳烃催化剂[N404608][27]。得到的螺内酯具有二烯结构,因此能与烯烃通过Diels-Alder反应一锅法合成具有光学活性的稠环化合物。此外,N404608还能用于构建不对称环缩醛[28]。
![]()

![]()

参考文献
1. U. Eder, G. Sauer, R. Wiechert, Angew. Chem. Int. Ed. 1971, 10, 496. https://doi.org/10.1002/anie.197104961
2. Z. G. Hajos, D. R. Parrish, J. Org. Chem. 1974, 39, 1615. https://doi.org/10.1021/jo00925a003
3. B. List, R. A. Lerner, C. F. Barbas III, J. Am. Chem. Soc. 2000, 122, 2395. https://doi.org/10.1021/ja994280y
4. K. A. Ahrendt, C. J. Borths, D. W. C. MacMillan, J. Am. Chem. Soc. 2000, 122,
4243. https://doi.org/10.1021/ja000092s
5. S. Mukherjee, J. W. Yang, S. Homan, B. List, Chem. Rev. 2007, 107, 5471. https://doi.org/10.1021/cr0684016
6. A. B. Northrup, D. W. C. MacMillan, Science 2004, 305, 1752. https://www.science.org/doi/10.1126/science.1101710
7. A. Córdova, M. Engqvist, I. Ibraham, J. Casas, H. Sundén, Chem. Commun.
2005, 2047. https://doi.org/10.1039/B500589B
8. S. Nakamura, N. Hara, H. Nakashima, K. Kubo, N. Shibata, T. Toru, Chem. Eur. J.
2008, 14, 8079. https://doi.org/10.1002/chem.200800981
9. (a) H. Kylmälä, A. Neuvonen, R. Jokela, Int. J. Org. Chem. 2013, 3, 162. https://pubmed.ncbi.nlm.nih.gov/23445843/
(b) V. Maya, M. Raj, V. K. Singh, Org. Lett. 2007, 9, 2593. https://doi.org/10.1021/ol071013l
10. (a) W. Yao, X. Dou, Y. Lu, J. Am. Chem. Soc. 2015, 137, 54. https://doi.org/10.1021/ja5109358
(b) X. Han, F. Zhong, Y. Wang, Y. Lu, Angew. Chem. Int. Ed. 2012, 51, 767.
https://doi.org/10.1002/anie.201106672
11. (a) Cinchona Alkaloids in Synthesis and Catalysis, ed. by C. E. Song, John
Wiley and Sons, 2009.
(b) Privileged Chiral Ligands and Catalysts, ed. by Q.-L. Zhou, John Wiley and
Sons, 2011.
(c) S. G. Hentges, K. B. Sharpless, J. Am. Chem. Soc. 1980, 102, 4263. https://doi.org/10.1021/ja00532a050
12. Y. Nakamoto, F. Urabe, K. Takahashi, J. Ishihara, S. Hatakeyama, Chem. Eur. J.
2013, 19, 12653. https://doi.org/10.1002/chem.201302665
13. U.-H. Dolling, O. Davis, E. J. J. Grabowski, J. Am. Chem. Soc. 1984, 106, 446. https://doi.org/10.1021/ja00314a045
14. T. Hashimoto, K. Maruoka, Chem. Rev. 2007, 107, 5656. https://doi.org/10.1021/cr068368n
15. T. Ooi, M. Kameda, K. Maruoka, J. Am. Chem. Soc. 1999, 121, 6519. https://doi.org/10.1021/ja991062w
16. R. He, S. Shirakawa, K. Maruoka, J. Am. Chem. Soc. 2009, 131, 16620. https://doi.org/10.1021/ja906821y
17. D. Enders, O. Niemeier, A. Henseler, Chem. Rev. 2007, 107, 5606. https://doi.org/10.1021/cr068372z
18. (a) M. He, J. R. Struble, J. W. Bode, J. Am. Chem. Soc. 2006, 128, 8418. https://doi.org/10.1021/ja062707c
(b) M. He, G. J. Uc, J. W. Bode, J. Am. Chem. Soc. 2006, 128, 15088. https://doi.org/10.1021/ja066380r
19. S. P. Brown, N. C. Goodwin, D. W. C. MacMillan, J. Am. Chem. Soc. 2003, 125,
1192. https://doi.org/10.1021/ja029095q
20. S. Lee, D. W. C. MacMillan, Tetrahedron 2006, 62, 11413. https://doi.org/10.1016/j.tet.2006.07.055
21. H.-Y. Jang, J.-B. Hong, D. W. C. MacMillan, J. Am. Chem. Soc. 2007, 129, 7004. https://doi.org/10.1021/ja0719428
22. R. M. Wilson, W. S. Jen, D. W. C. MacMillan, J. Am. Chem. Soc. 2005, 127, 11616. https://doi.org/10.1021/ja054008q
23. Y. Bai, X. Shen, Y. Li, M. Dai, J. Am. Chem. Soc. 2016, 138, 10838. https://doi.org/10.1021/jacs.6b07585
24. Y. Hayashi, H. Gotoh, T. Hayashi, M. Shoji, Angew. Chem. Int. Ed. 2005, 44,
4212. https://doi.org/10.1002/anie.200500599
25. H. Ishikawa, T. Suzuki, Y. Hayashi, Angew. Chem. Int. Ed. 2009, 48, 1304. https://doi.org/10.1002/anie.200804883
26. S. Cabrera, J. Alemán, P. Bolze, S. Bertelsen, K. A. Jørgensen, Angew. Chem. Int.
Ed. 2008, 47, 121. https://doi.org/10.1002/anie.200704076
27. M. Uyanik, T. Yasui, K. Ishihara, Angew. Chem. Int. Ed. 2013, 52, 9215. https://doi.org/10.1002/anie.201303559
28. M. Uyanik, N. Sasakura, M. Mizuno, K. Ishihara, ACS Catal. 2017, 7, 872. https://doi.org/10.1021/acscatal.6b03380
 首页
首页 400-620-6333
400-620-6333
